西安交大吴道澄教授团队《ACS Nano》:光热/化学动力学/化疗“最佳性价比”程序化肿瘤协同治疗
发布者:
吴道澄
|
2023-07-30
|
12034
恶性肿瘤严重威胁人类生命健康安全,为了攻克这一难题,人们开发了一系列肿瘤治疗方法。包括传统的化疗、放疗和新兴的光热疗、化学动力学治疗、免疫治疗、饥饿治疗等。其中光热疗强度高、短期疗效好,但治疗时间短(分钟级)、对深部肿瘤疗效并不显著;化学动力学治疗具有中等的作用时间(小时级),但是单独使用效率有限;化疗持续作用时间超长(可超过48小时),但存在短期疗效差、肿瘤耐药且毒副作用大等缺点。因此单独的肿瘤治疗方法往往不能达到满意的治疗效果,而将多种治疗方法联合使用可以充分发挥各自的优势,不同方法取长补短能得到更好的治疗效果。但是如何使联合治疗达到最佳效果和最低付出则成为一个难题,目前的联合治疗大多仅是不同疗法的简单加和,未能充分发挥联合治疗的作用,不能做到以最低的功率和剂量达到最佳的治疗效果(即最佳性价比:Cost-effective)。在治疗时间的控制上,也未能根据各种疗法的特点进行优化。
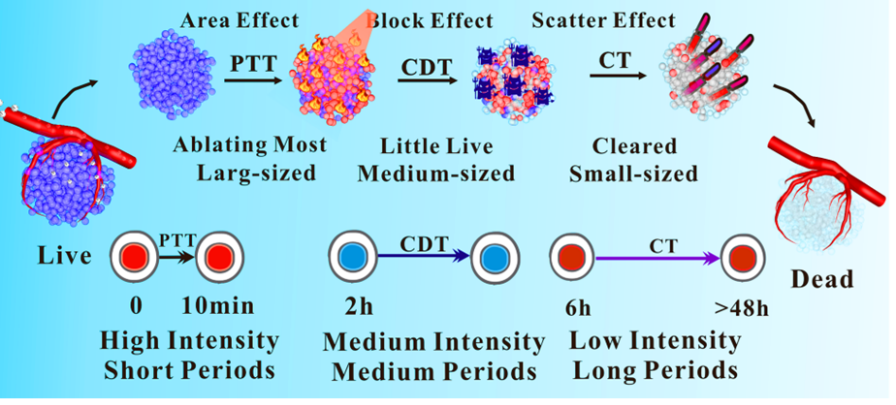
图1-光热/化学动力学/化疗程序化肿瘤协同治疗策略
针对上述问题,西安交大生命学院生物医学影像与应用研究所的吴道澄教授课题组提出了一种“最佳性价比”的光热/化学动力学/化疗程序化肿瘤协同治疗新方法,以最低的功率和剂量最大化地实现了治疗效果并大幅减少治疗副作用。这种疗法按照时间顺序将光热疗、化学动力学治疗和协同双药化疗三种治疗方式进行了程序化的组合(见图1)。根据肿瘤的状态或体积对每种治疗方式的时间和强度进行了优化并使其按时间顺序分别作用。
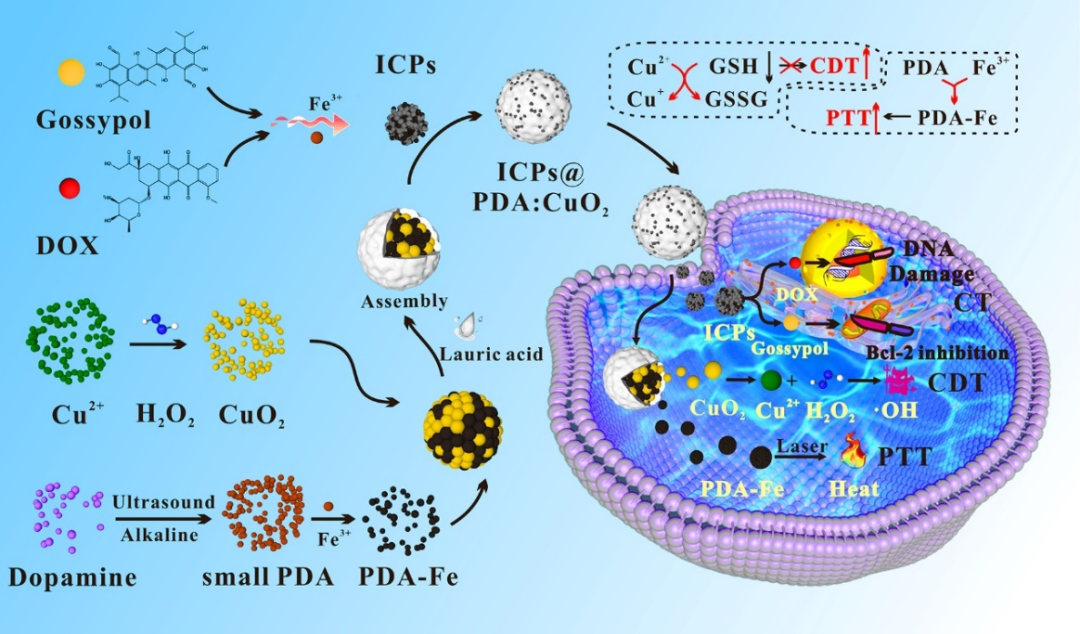
图2- ICPs@PDA:CuO2 NPs的合成与肿瘤治疗示意图。
为了实现该策略,课题组研究人员针对PC-3肿瘤模型设计了集成高光热转换效率治疗剂配位聚多巴胺(PDA-Fe)、化学动力学治疗剂CuO2和协同化疗剂阿霉素-棉酚无限配位聚合物(ICPs)的联合治疗系统(ICPs@PDA:CuO2 NPs)。
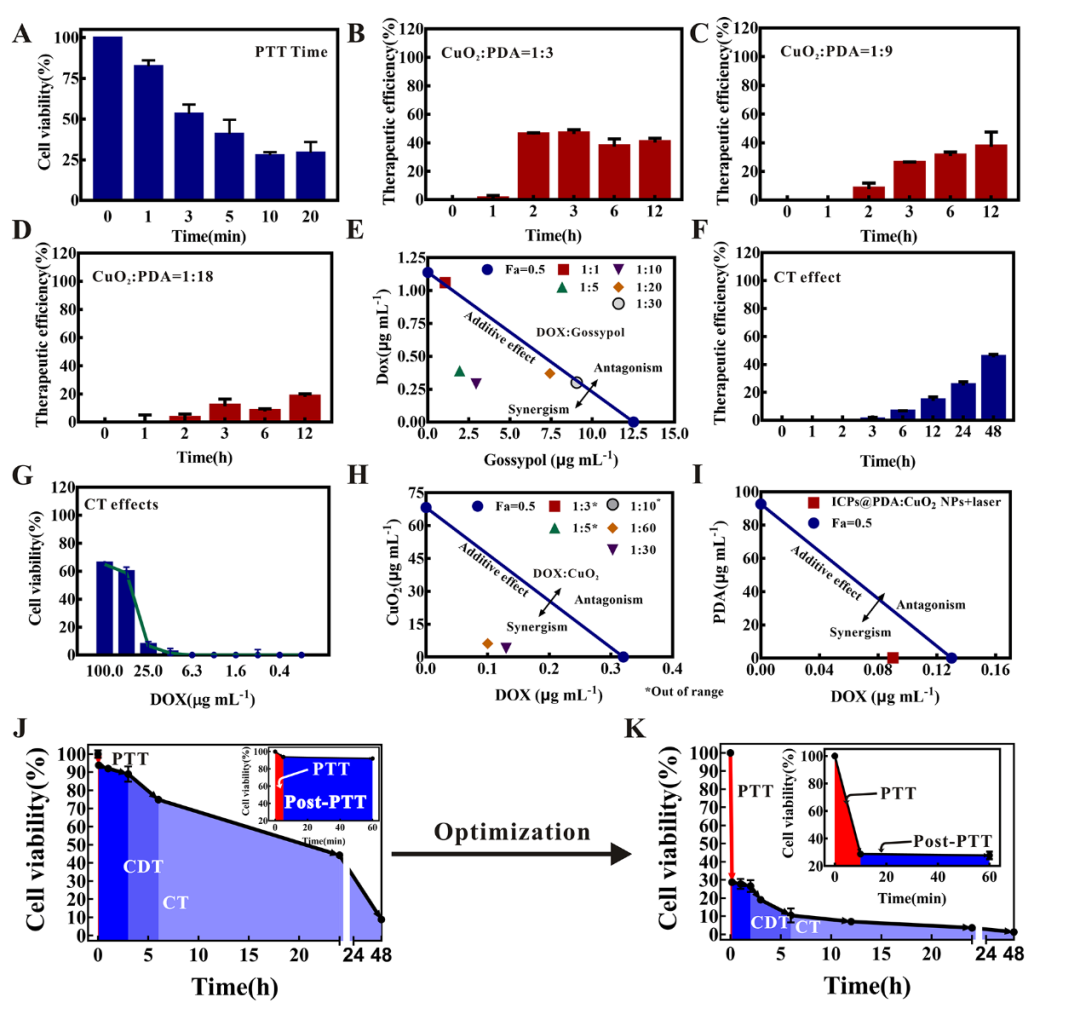
图3-非最优化治疗策略与优化后实验策略的比较。(A) PC-3细胞在相同NIR照射下1-20分钟内的细胞存活率。(B)~(D)不同的CuO2:PDA比例下的治疗效率。(E)不同DOX和gossypol比例的等效线图。(F)不同时间段内CT的治疗效率变化。(G)肿瘤细胞用不同浓度化疗药处理4小时后的活力变化。(H)不同化疗药物和CuO2比例组合的等效线(I)PTT和ICPs@PDA:CuO2NPs组合的等效线。(J)非最佳疗法下的细胞活性变化。(K)最佳疗法下的细胞活性变化。
该复合纳米粒子尺寸为116.45±18.32 nm,其核由1~3 nm的PDA-Fe和CuO2组成,外部表面负载4~6 nm的阿霉素-棉酚无限配位聚合物,具有高达52.4%的光热转换效率,能够在肿瘤细胞内特异性地生自由基进行化学动力学治疗并清除谷胱甘肽,所负载的ICPs能够在肿瘤细胞内释放出两种作用机理不同的化疗药物(图2)。
通过一系列的细胞毒性实验确定了ICPs@PDA:CuO2NPs的最优化治疗时间和强度。PTT实验结果表明,当NIR激光照射时间超过10分钟后,PTT的疗效将不会显著增加(图3A)。图3B~D的结果显示,通过调整CuO2和PDA的比例可以控制CDT的起始点和作用时间。当CuO2与PDA的比例为1:3时,CDT在2小时后开始发生作用,显示出了比其他组合更高的疗效。图3E的结果显示,DOX:gossypol为1:5的比例具有最佳协同作用。由于后续实验中使用的CT药物剂量(<2.5μg/mL)均低于图3F和G中的阈值,因此药物浓度对CT起始作用时间的影响可以忽略不计。而化疗药物的长效作用可以持续超过48小时。综合上述结论与图3H~I中的结果,ICPs@PDA:CuO2 NPs中DOX:gossypol:CuO2:PDA的最佳最终比例确定为1:5:30:90。经过优化设计后的ICPs@PDA:CuO2 NPs包含1.25μg/mL的DOX、6.25μg/mL的棉酚、37.5μg/mL的CuO2和112.5μg/mL的PDA-Fe。图3J~K是非最优化治疗策略与优化后实验策略的比较,结果显示:两种情况下的细胞活力曲线均显示出明显的三阶段降低,表明PTT、CDT和CT程序化地作用。此外,曲线下面积可以反映整个治疗的总消耗量,较小的面积表示较高的效率和较低的消耗(即更具“性价比”)。最优协同治疗策略为:首先进行10分钟高强度光热疗以消除较大的肿瘤,接着进行持续数小时的中等强度化学动力学治疗以消除中等大小的肿瘤,最后通过低强度但持续超过48小时的协同双药化疗清除较小的残余肿瘤并抑制复发。
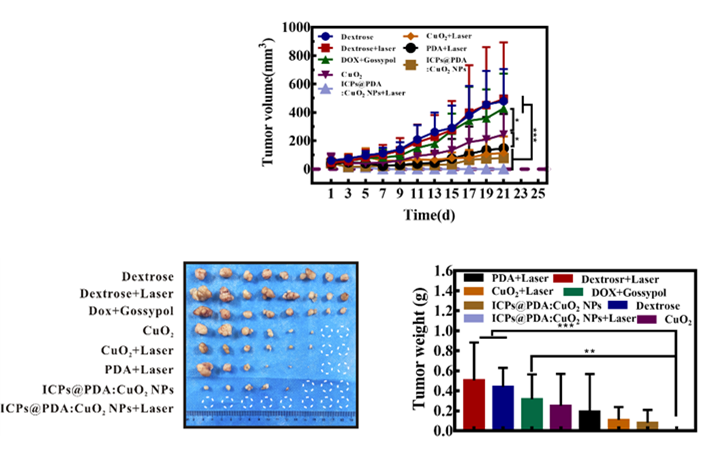
图4-ICPs@PDA:CuO2 NPs的体内抗肿瘤结果
在图4中发现,对照组肿瘤的体积约增大8倍,而ICPs@PDA:CuO2 NPs+光热疗组在第2和第5天分别接受了持续10分钟的1.5 W/cm2近红外激光照射。在这过程中, ICPs@PDA:CuO2 NPs与近红外激光介导的光热-化学动力学-化疗联合治疗显著地抑制了肿瘤生长。CuO2组、PDA-Fe+光热疗组、ICPs@PDA:CuO2 NPs组和CuO2+光热疗组的肿瘤抑制率分别为49.8%、61.9%、71.5%和78.2%,而该系统使光热疗、化学动力学治疗和化疗在不同时间分别起作用,实现了优异的协同效应,用最低的功率和最小的药物剂量实现了近100%的肿瘤抑制效果,小鼠肿瘤在接受治疗后的60天内未复发。该光热/化学动力学/化疗协同疗法具有程序化可设计的特点,一旦启动自动执行,还可以根据需要对系统中不同治疗剂的比例及治疗方案进行相应的调节,针对不同肿瘤采用不同程序化三模态的治疗策略,实现精准个性化的治疗。
该工作以《阿霉素-棉酚无限配位聚合物聚多巴胺-过氧化铜复合纳米粒子用于“最佳性价比”程序化光热-化学动力学-双药协同化疗三模式协同肿瘤治疗》(“Doxorubicin-Fe(III)-Gossypol Infinite Coordination Polymer@PDA:CuO2 Composite Nanoparticles for Cost-Effective Programmed Photothermal-Chemodynamic-Coordinated Dual Drug Chemotherapy Trimodal Synergistic Tumor Therapy”)为题在著名期刊《美国化学会·纳米》(ACS Nano, IF=17.1)上在线发表。文章第一作者为西安交通大学生命学院博士生朱红瑞,西安交通大学生物医学信息工程教育部重点实验室和生命学院为该论文的第一和通讯作者单位,吴道澄教授为唯一通讯作者。该研究成果是吴道澄教授课题组在肿瘤联合治疗领域的又一重要进展。
该工作得到了国家自然科学基金、国家重大科学仪器设备项目和陕西省重点研发计划项目的资助。西安交通大学分析测试中心和生物医学实验中心为本工作提供了大量研究支持。
论文链接:
https://doi.org/10.1021/acsnano.3c02401
-
2022
07-14
-
2022
04-21
-
2021
12-09
-
2021
07-13
-
2021
05-18
-
2020
12-24

 (创新港)
(创新港)


